
Si buscas
hosting web,
dominios web,
correos empresariales o
crear páginas web gratis,
ingresa a
PaginaMX
Por otro lado, si buscas crear códigos qr online ingresa al Creador de Códigos QR más potente que existe


Bienvenid@s a la página del Profe de Química!
Guía correspondiente al BLOQUE II que entregarás contestada al profesor de Química.
INSTRUCCIONES
*Escribirla a mano, utilizar dos tintas, en hojas de papel ministro o papel bond (hojas de "máquina") tamaño carta
* Deberás entregarla a tu profesor de QUÍMICA el día del examen.
EN TOTAL SON 44 aseveraciones.
Nota: LAS RESPUESTAS DEBES BUSCARLAS EN EL LIBRO DE CIENCIAS III. También puedes buscarlas en una enciclopedia, diccionario y/o INTERNET
1.- Se le considera como el químico más importante y Padre de la Tabla Periódica gracias a sus aportaciones a la química:
R= Dimitri Mendeleiev
2.- En la antiguedad Demócrito definió a esta partícula como la más pequeña e indivisble:
R= átomo.
3 .- Es una sustancia química compuesta por átomos del mismo tipo (no es posible descomponerla en sustancias más simples) :
R= Elemento.
4.- Menciona siete ejemplos de elementos y su símbolo:
R= Oro Ag, Plomo Pb, Oxígeno O, Nitrógeno N, Hierro Fe, Carbono C.
5.- ¿Qué es un compuesto?
R= Se refiere a una sustancia formada por diferentes tipos de átomos, es decir, la unión de dos o más elementos químicos.
6.- Es un elemento químico perteneciente a los metales, es muy blando y reacciona violentamente al contacto con el agua, su símbolo es Na:
R=
7.- Escribe diez ejemplos de compuestos y su fórmula química:
R= Agua H20
Sal de mesa NaCl
amoniaco NH3
Ácido sulfúrico (H2SO4)
Glucosa (C6H12O6)
Etanol (C2H6O)
Sacarosa (C12H22O11).
Peróxido de hidrógeno H2O2
ácido clorhidrico HCl
ácido acetico (vinagre) CH3COOH
8.- Es un sistema formado por dos o más sustancias, no combinados químicamente:
R= Mezcla.
9.- Menciona los tipos de Mezclas:
R= Homogéneas y Heterogéneas
10.- Escribe siete ejemplos de Mezclas Homogéneas:
R=
11.- Enumera ocho ejemplos de Mezclas Heterogéneas:
R=
12.- El elemento más abundante en la masa total de la superficie de nuestro planeta es el:
R= Oxígeno.
13.- Dibuja el modelo atómico de Bohr, e identifica sus partes:
.jpg)
14.- Las propiedades de los metales que se utilizan para fabricar material de construcción como cableado de cobre y láminas para techo son:
R= un metal es DÚCTIL cuando permite permite formar alambre e hilos.
Y la MALEABILIDAD permite formar láminas.
15.- Define qué es la REGLA DEL OCTETO:
R=
16.- ¿Qué es TENACIDAD?
R=
17.- Escribe la definición de VISCOSIDAD:
R=
18.- Define el concepto "ELECTRONES DE VALENCIA":
R= Los electrones de valencia son los electrones que un átomo puede compartir para formar enlaces con otros átomos y éstos se encuentran en el último nivel de energía o ÚLTIMA ÓRBITA del átomo, es por esto que son los principales responsables del tipo de enlace.
19.- Definición de ELECTRONES ENERGÉTICOS:
R= Son los electrones que se localizan cerca del núcleo, es decir los que son atraídos por el núcleo con mayor fuerza.
20.- ¿Cuál es el peso molecular del agua, si el peso atómico del hidrogeno es 1 y del oxígeno es 16?
R= Peso Molecular del Agua: 1 + 1 + 16 = 18.
esto es porque la masa del Hidrógeno = 1 y
la masa del Oxígeno es = 16
entonces H2O = 2x1 (dos Hidrógenos) = 2 + 16 (un Oxígeno 1x16) = 18
21. Se le llama así al grupo de la TABLA PERIÖDICA cuya característica es que tienen tres electrones en su capa más externa:
R= Térreos o grupo del Boro.
22.- Grupo de la Tabla Periódica en la que sus elementos que tienen un solo electrón en su nivel energético más externo, con tendencia a perderlo:
R= Grupo IA de los METALES ALCALINOS.
23.- Define cuales son los Metales Alcalinotérreos:
R=
24.- Elemento químico que se encuentra en forma de gas verdoso, de olor penetrante, muy oxidante y su símbolo es Cl:
R= Cloro
25.- Escribe qué es un ENLACE COVALENTE:
R=
26.- En una mezcla o disolución, al componente que se encuentra en mayor proporción se le nombra:
R= disolvente
27.- Menciona la definición de ENLACE METÁLICO:
R=
28.- ¿Qué es un ENLACE iónico?
R=
29.- Son las características de un enlace iónico:
R= Es la unión de un elemento METAL y un elemento NO METAL,
y Tienen altos puntos de fusion y ebullicion.
30.- Calcula el número de neutrones del Na (Sodio), si el número de protones es 11 y el peso atómico es de 23:
R= 12 neutrones
Se calcula de la siguiente manera: http://es.wikihow.com/encontrar-el-n%C3%BAmero-de-neutrones-en-un-%C3%A1tomo
(visita la página)
31.-Dibuja la Tabla Periódica e Identifica los distintos grupos de acuerdo a su organización:
.jpg)
32.- ¿Cuál es el símbolo que se utiliza para identificar el NÚMERO ATÓMICO en química?
R= Z
33.- ¿Qué es el número atómico?
R=
34.- ¿Qué es la masa atómica?
R=
35.- Dibuja los siguientes modelos de ion, molécula, atomos y elemento:
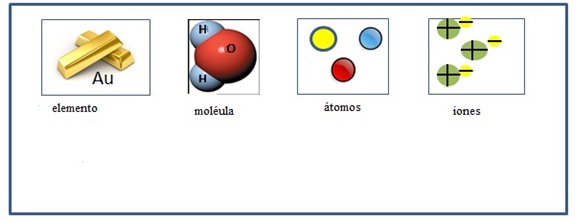
36.- Científico Fisicoquímico estadounidense que postuló un modelo sobre la estructura del átomo representada por puntos, en la que se representan los electrones de valencia:
R= Gilbert LEWIS.
37.- Científico RUSO que ordenó los elementos de acuerdo a su peso atómico en la llamada TABLA PERIÓDICA que actualmente utilizamos:
R= Dimitri Mendeleiev.
38.- Personaje que propuso la LEY ESTEQUIOMÉTRICA sobre la combinación de sustancias gaseosas:
R= Gay-Lussac
39.- Elabora la siguiente línea de tiempo referente a la historia de los diferentes modelos atómicos propuestos por Dalton, Thompson, Rutherford, Bohr y Schrödinger:

40.- Científico que consideraba a los átomos como pequeñas esferas que no pueden dividirse:
R= John Dalton
41.- A continuación completa la información escribiendo el nombre de los siguientes elementos y representalos según la estructura de Lewis (diagrama de puntos) de acuerdo a sus electrones de valencia (investígalos en la tabla periódica de elementos y en la página 88 de tu libro de química):
Símbolo --Nombre del elemento --Electrones de valencia --Diagrama de puntos (Estructura de Lewis)
Li Litio 1 Li •
O Oxígeno 6
B 3
Fl Fluor 7
N Nitrógeno 5
C 4
Ne 8
S 6
Be 2
H Hidrógeno 1 H•
42.- Es la capacidad para conducir la corriente de electrones o corriente eléctrica:
R= Conductividad
43.- Dibuja el siguiente "ENLACE IONICO" de la molécula del Cloruro de Sodio NaCl
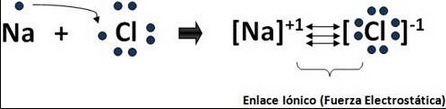
**En los siguientes hipervínculos podrás apreciar más información sobre el enlace ionico del Cloruro de Sodio (sal de mesa)
http://clasesdequimica.blogspot.mx/2012/04/enlace-ionico-y-cloruro-de-sodio.html
http://formulasmoleculasycompuestos.blogspot.mx/2011/08/cloruro-de-sodio.html
44.- Escribe un breve ensayo (media cuartilla) sobre la SEGUNDA REVOLUCIÓN QUÍMICA, en el que menciones los científicos más importantes y sus aportaciones a la química:
Envía un mensaje a esta cuenta de correo electrónico: ciencias3@ymail.com
![]()
![]()
![]()
![]()
![]()